Qualified Person Schulung – Verantwortliche Person nach Art. 15 MDR / IVDR
Die Qualified Person Schulung vermittelt Ihnen alle Anforderungen an die Verantwortliche Person nach Artikel 15 MDR / IVDR (PRRC). Der Online-Kurs richtet sich an Hersteller, Bevollmächtigte sowie Fachkräfte aus Regulatory Affairs und Qualitätsmanagement, die ihre gesetzlich vorgeschriebene Rolle sicher erfüllen möchten.
5-6 Stunden
Einstieg jederzeit
Zertifikat
339,00 EUR
In kurzer Zeit fit für die Praxis
Beginnen Sie Ihre Weiterbildung zur "Person Responsible for Regulatory Compliance (PRRC)" nach Artikel 15 der MDR und IVDR

Die EU-Verordnungen für Medizinprodukte (MDR) und In-vitro-Diagnostika (IVDR) verlangen gemäß Artikel 15 eine „Für die Einhaltung der Regulierungsvorschriften verantwortliche Person (PRRC)“ für Hersteller und Bevollmächtigte. Dieser Kurs vermittelt Ihnen neben den Grundlagen, die wesentlichen Neuerungen im Medizinprodukterecht, die Verantwortungen der Qualified Person sowie die relevanten Aspekte des Beobachtungs- und Meldesystems.
In eigenem Tempo die Schulung zur Verantwortlichen Person nach Artikel 15 durchführen
Erforderliche Qualifikation erwerben
Zielgruppe: Mitarbeitende von Herstellern und Bevollmächtigten, die als Verantwortliche Personen benannt werden sollen, ehemalige Sicherheitsbeauftragten für Medizinprodukte, Fach- und Führungskräfte aus Regulatory Affairs, Qualitätsmanagement oder Clinical Affairs, die mit regulatorischen Anforderungen vertraut sind.
Voraussetzungen: Anforderungen „Für die Einhaltung der Regulierungsvorschriften verantwortlichen Person“ gemäß Art. 15 Absatz 1 der Verordnungen (EU) 2017/745 und (EU) 2017/746
Kursart: Online-Selbstlern-Kurs
Die E-Learning Schulung „Qualified Person nach Artikel 15 MDR / IVDR“ setzt keine speziellen Kenntnisse voraus. Die relevanten Grundlagen werden im Rahmen des Kurses vermittelt. Wer als „Für die Einhaltung der Regulierungsvorschriften verantwortliche Person (PRRC)“ tätig sein möchte, muss neben den vermittelten Grundlagen über eine entsprechende Berufsausbildung und -erfahrung verfügen. Dies hat der Hersteller/Bevollmächtigte der zuständigen Behörde nachzuweisen. Die hochwertigen Schulungsunterlagen sind fachlich und didaktisch aufbereitet und zusammengestellt. Die Inhalte werden in Zusammenarbeit mit erfahrenen Auditoren und Beratern aus der Medizin- und Gesundheitsbranche erstellt.
Erwerben Sie die erforderliche Qualifikation mit Trautmann Schulungen.
Einfache und schnelle Anmeldung zum Online Kurs
Wählen Sie Ihren Buchungsweg: Rechnung (Formular) · PayPal (Direkt buchen) · Gruppen/Unternehmen (Anfrage)
Formular
-
1. Formular ausfüllen und zurücksenden
-
2. Rechnungsbetrag überweisen
-
3. Freischaltung und Erhalt der Zugangsdaten
-
4. Kurs starten
Direkt buchen
-
1. Ein kostenloses Kundenkonto erstellen
-
2. Gewünschten Kurs auswählen
-
3. Teilnahmegebühr mit PayPal bezahlen
-
4. Kurs starten
Angebot
-
Sonderkonditionen ab 10 Teilnehmern
-
Sparen mit dem Abo-Modell
-
Eigene Lernplattform für Unternehmen
-
Individuelle Kurse
Aufbau des Kurses
Inhalte und Ablauf
1. Modul: Medizinprodukterecht
Zu Beginn erhalten Sie einen Überblick über das europäische und deutsche Medizinprodukterecht. Schwerpunkt sind die fundierten Kenntnisse der neuen gesetzlich vorgeschriebenen Anforderungen aus MDR und IVDR. In diesem Zusammenhang wird die Position der verantwortlichen Person (Qualified Person) erstmals vorgestellt.
2. Modul: Qualified Person
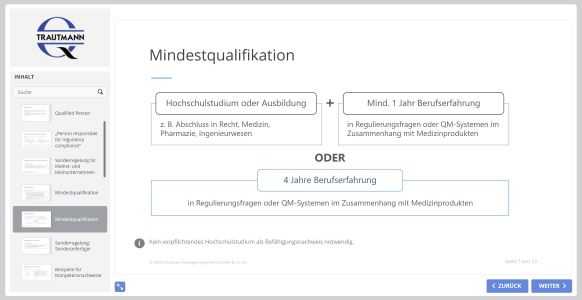
Sie erfahren, wer nach Art. 15 MDR / IVDR eine „Für die Einhaltung der Regulierungsvorschriften verantwortliche Person (PRRC)“ benennen muss und welche Qualifikationen gemäß Gesetzgebung erforderlich sind. Die Aufgabenbereiche dieser sachkundigen Person werden praxisnah erläutert. Zudem wird eine zulässige Sonderregelung für bestimmte Unternehmensformen vorgestellt.
3. Modul: Medizinprodukte
Im Zentrum stehen die grundlegenden Sicherheits- und Leistungsanforderungen. Begrifflichkeiten rund um Medizinprodukte werden definiert und von Arzneimitteln abgegrenzt – ein zentraler Aspekt für fundierte regulatorische Kenntnisse.
4. Modul: In-vitro-Diagnostika
Dieses Modul vermittelt Ihnen einen Überblick über den Einsatz und die Anwendung von In-vitro-Diagnostika. Verschiedene Begrifflichkeiten werden Ihnen erläutert und mit Beispielen verdeutlicht.
5. Modul: Klassifizierung
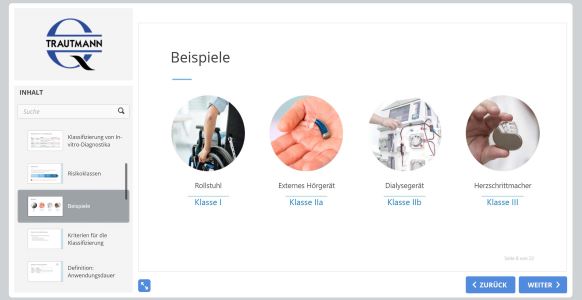
Behandelt werden die Kriterien für die Klassifizierung von Medizinprodukten und In-vitro-Diagnostika nach Risikoklassen. Es folgen Beispiele mit Erläuterung.
6. Modul: Konformitätsbewertung
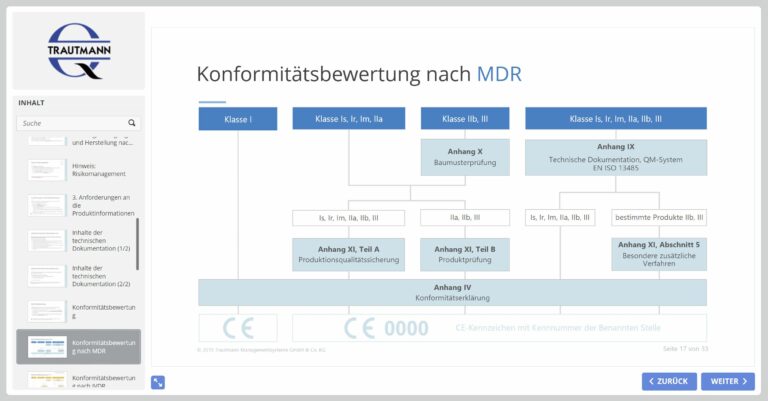
Im fünften Modul erhalten Sie einen Überblick zu den Konformitätsbewertungsverfahren sowie den Inhalten der technischen Dokumentation.
7. Modul: Kennzeichnung von Medizinprodukten und In-vitro-Diagnostika
Schwerpunkte dieser Lerneinheit sind das CE-Kennzeichen, grafische Symbole zur Kennzeichnung von Medizinprodukten und In-vitro-Diagnostika sowie das neue UDI-System.
8. Modul: Beobachtungs- und Meldesystem
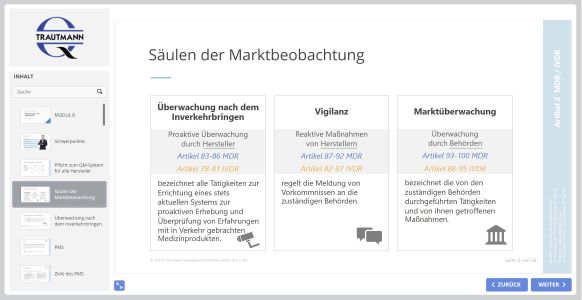
Zum Abschluss befassen Sie sich mit dem internen und externen Meldewesen. Lernen Sie in diesem Modul insbesondere die Formen der Marktbeobachtung zu unterscheiden: Überwachung nach dem Inverkehrbringen, Vigilanz und Marktüberwachung durch die Behörden. Sie erhalten einen Überblick zur Vigilanz in der MPAMIV, zur Einstufung von Vorkommnissen sowie den Ablauf einer Meldung bei der zuständigen Behörde. Im Fokus steht abschließend die Koordinierung notwendiger Maßnahmen.
Auszug aus den Schulungsunterlagen
Lebendiger Methodenmix mit konkreten Beispielen


Online-Seminar
Flexibilität beim Lernen
Für die berufliche Weiterbildung stehen weniger Ressourcen zur Verfügung. Da die Zeit besonders knapp ist, müssen sich Weiterbildungsmöglichkeiten gut in den Berufsalltag integrieren lassen. Online-Schulungen können daher jederzeit und überall individuell durchgeführt werden und sind eine gute Alternative zu herkömmlichen Präsenzseminaren. Deshalb bieten wir Ihnen die Ausbildung zur Verantwortlichen Person nach Art. 15 MDR / IVDR (Qualified Person) als bewährte Online-Ausbildung an und geben Ihnen so absolute Flexibilität für die weitere Ausbildung.
Lernen und vertiefen Sie notwendiges Wissen Schritt für Schritt – in Ihrem eigenen Lerntempo und bei individueller Zeiteinteilung.
Die E-Learning Schulung wird nach erfolgreichem Test mit dem Zertifikat „Verantwortliche Person nach Art. 15 MDR/IVDR“ abgeschlossen. Buchen Sie jetzt den Online-Kurs „Verantwortliche Person nach Art. 15 MDR/IVDR“ direkt online oder stellen Sie eine Anfrage für ein individuelles Angebot für eine Präsenz-Schulung, wenn Sie Ihr Zertifikat lieber in einem fest geplanten Zeitraum mit persönlichem Dozenten erwerben möchten.
Stimmen unserer Kurs-Teilnehmer
Das sagen unsere Kunden
Noch Fragen zur Schulung?
Antworten zu Inhalten, Ablauf und Teilnahme finden Sie in unseren FAQ.
Für organisatorische oder gruppenbezogene Fragen unterstützen wir Sie gerne persönlich.
Schulungen: +49 34293 4797-27

