Schulung Medizinprodukte-Verordnung (MDR)
Der Online-Kurs bietet Ihnen eine leicht verständliche Einführung in die MDR (Medical Device Regulation). Sie erhalten einen umfassenden Überblick über die Rechtslage und die wichtigsten Anforderungen.
Komplexe Inhalte einfach erklärt
Durchdringen Sie den Dschungel der MDR

Hersteller von Medizinprodukten sowie Handels- und Servicepartner müssen sich mit den erweiterten Anforderungen der Medizinprodukte-Verordnung auseinandersetzen. Diese betreffen vor allem: Produktklassifizierung, technische Dokumentation, klinische Bewertung und Prüfung, UDI-System, Eudamed sowie Marktbeobachtung und -meldung. Die Schulung vermittelt einen Überblick zur neuen Rechtslage und den damit einhergehenden Pflichten.
5-6 Stunden
Einstieg jederzeit
Teilnahmebesch.
289,00 EUR
In eigenem Tempo
Neue Kenntnisse erwerben
Zielgruppe: Hersteller von Produkten, die in den Geltungsbereich der Medizinprodukte-Verordnung (MDR) fallen
Voraussetzungen: keine
Kursart: Online-Selbstlern-Kurs
Der Kurs „Verordnung (EU) 2017/745“ setzt keine speziellen Kenntnisse voraus. Die relevanten Grundlagen werden im Rahmen der Schulung vermittelt.
Hersteller von Medizinprodukten und weitere Wirtschaftsakteure müssen die geltenden Anforderungen mit der gebührenden Sorgfalt berücksichtigen und umsetzen.
Die hochwertigen Schulungsunterlagen sind fachlich und didaktisch aufbereitet und zusammengestellt. Die Inhalte werden in Zusammenarbeit mit erfahrenen Auditoren und Beratern aus der Medizin- und Gesundheitsbranche erstellt.
Die Medical Device Regulation (MDR) ersetzt die Medizinprodukterichtlinie 93/42/EWG (Medical Device Directive, MDD). Seit dem 26. Mai 2021 müssen Hersteller beim erstmaligen Inverkehrbringen von Medizinprodukten die Anforderungen der MDR berücksichtigen und umsetzen.
Jeder Hersteller von Medizinprodukten sowie Handels- oder Servicepartner müssen sich daher mit den neuen Anforderungen auseinandersetzen. Das Seminar richtet sich an Personen, die für Medizinproduktehersteller im Bereich Regulatory Affairs und Qualitätsmanagement tätig sind.
Erwerben Sie die erforderliche Qualifikation mit Trautmann Schulungen.
Inhalte und Ablauf
Aufbau des Kurses
1. Modul: Medizinprodukte-Verordnung
Das erste Modul beginnt mit einem Überblick zur europäischen Medizinprodukte-Verordnung, MDR. Es werden Übergangsbestimmungen und Geltungsbeginn erläutert. Die neuen und erweiterten Anforderungen werden übersichtlich dargestellt und einführend behandelt.
2. Modul: Geltungsbereich
Der Geltungsbereich der Verordnung über Medizinprodukte wurde erweitert. Als Hersteller müssen Sie entsprechend Ihr Produktportfolio überprüfen, um herauszufinden, ob im Vergleich zu den Richtlinien mehrere Ihrer Produkte in den Geltungsbereich der Verordnung fallen. Zu beachten sind die in Anhang XVI aufgeführten Produktgruppen ohne medizinische Zweckbestimmung, die unter die Verordnung fallen. In diesem Modul werden außerdem Begriffe wie Medizinprodukt, Sonderanfertigung und Serienprodukt definiert und unterschieden.
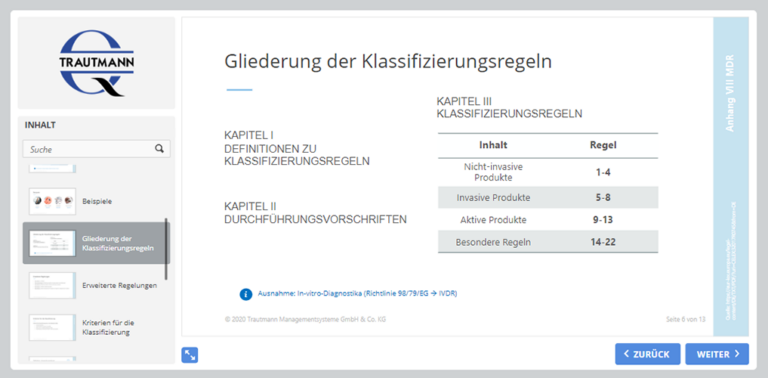
3. Modul: Klassifizierung
Produkte werden unter Berücksichtigung ihrer Zweckbestimmung und der damit verbundenen Risiken in Klassen eingestuft. Das Modul behandelt neben den Kriterien für die Klassifizierung, ebenso die Vorschriften nach Anhang VIII MDR. Sie erhalten einen Überblick zu den erweiterten Klassifizierungsregeln sowie Informationen zur Höherklassifizierung von Produkten.
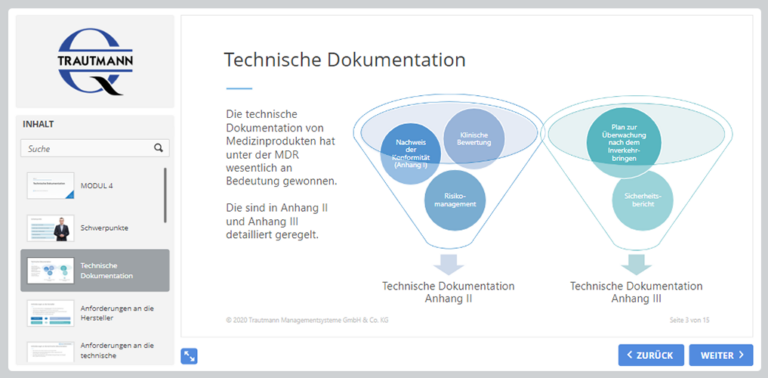
4. Modul: Technische Dokumentation
Die technische Dokumentation hat unter der MDR wesentlich an Bedeutung gewonnen. Das Modul behandelt sowohl die Anforderungen an die Hersteller als auch die Anforderungen an die technische Dokumentation. Darüber hinaus werden die grundlegenden Sicherheits- und Leistungsanforderungen benannt.
5. Modul: Konformitätsbewertung
Die Zuordnung der Produkte zu einer Risikoklasse ermöglicht es dem Hersteller festzustellen, welches Konformitätsbewertungsverfahren durchzuführen ist und ob eine benannte Stelle eingebunden werden muss. Im fünften Modul vertiefen Sie zudem die Neuerungen rundum die EU-Konformitätserklärung, Geltungsdauer der Konformitätsbescheinigung sowie das Konsultationsverfahren (Scrutiny-Verfahren).
6. Modul: Kennzeichnung
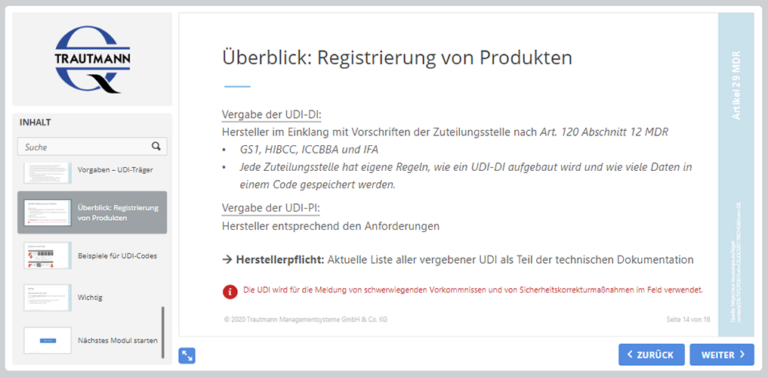
Erlernen Sie alle relevanten Aspekte in Zusammenhang mit der CE-Kennzeichnung und der einmaligen Produktkennung (UDI). Kennen Sie bereits die Fristen der UDI-Einführung sowie die geltenden Vorgaben des UDI-Trägers?
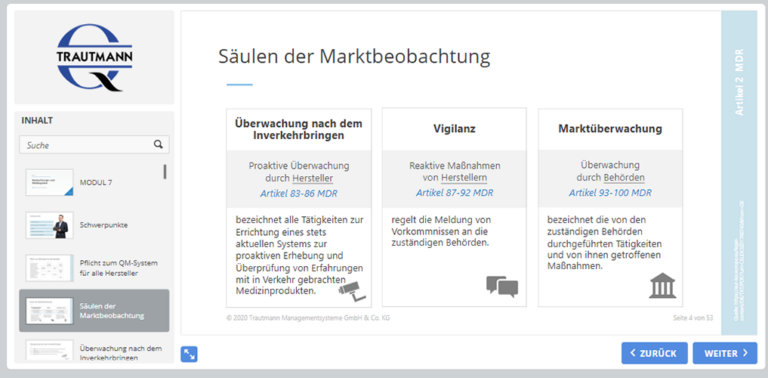
7. Modul: Beobachtungs- und Meldesystem
Das letzte Modul erklärt die Säulen der Marktbeobachtung. Von der Überwachung nach dem Inverkehrbringen (PMS) inklusive der klinischen Nachbeobachtung und den damit verbundenen Plänen und Berichten, über die Meldepflicht im Rahmen der Vigilanz bis hin zur Marktüberwachung durch die Behörden. Das Training endet mit einer Aufzählung zum Handlungsbedarf.
Lebendiger Methodenmix mit konkreten Beispielen
Auszug aus den Schulungsunterlagen
Das sagen unsere Kunden
Stimmen unserer Kurs-Teilnehmer
Mein Zeitbedarf (mit Vorwissen) war 3-4 Stunden, was ich für angemessen und machbar erachte. So hatte eine lange Zugfahrt für mich einen richtigen Nutzen. Der Preis ist m.E. angemessen."
Flexibilität beim Lernen
Online-Seminar
Weiterbildungsmöglichkeiten sollen nun problemlos in den Arbeitsalltag integrierbar und an die individuellen Gegebenheiten anpassbar sein. Da die Zeit meist knapp ist, bieten sich Online-Schulungen an. Sie sind nicht mehr auf Ort und Zeit angewiesen, sondern können selbst entscheiden, wann und wo Sie Ihren Kurs besuchen. Buchen Sie einfach unsere Online-Schulung zur Medical Device Regulation (MDR). Auf Wunsch bieten wir auch Schulungen in Präsenzworkshops an.
Sie können unsere Online-Kurse zum Selbststudium in Ihrem eigenen Tempo absolvieren und so nach und nach die besten Ergebnisse erzielen. Nach Abschluss des Kurses erhalten Sie von uns eine Teilnahmebescheinigung gemäß der MDR-VERORDNUNG (EU) 2017/745.
Buchen Sie den Online-Kurs „Medizinprodukteverordnung (MDR), Verordnung (EU) 2017/745“ jetzt online oder stellen Sie eine Anfrage für eine Präsenzschulung, um innerhalb der geplanten Zeit eine Teilnahmebescheinigung von Ihrem eigenen Dozenten zu erhalten.
Stellen Sie Ihre Buchungsanfrage über unser Kontaktformular oder buchen Sie den Kurs direkt per PayPal.
Einfache und schnelle Anmeldung zum Online Kurs
Formular
-
1. Formular ausfüllen und zurücksenden
-
2. Rechnungsbetrag überweisen
-
3. Freischaltung und Erhalt der Zugangsdaten
-
4. Kurs starten
Direkt buchen
-
1. Ein kostenloses Kundenkonto erstellen
-
2. Gewünschten Kurs auswählen
-
3. Teilnahmegebühr mit PayPal bezahlen
-
4. Kurs starten
Angebot
-
Sonderkonditionen ab 10 Teilnehmern
-
Sparen mit dem Abo-Modell
-
Eigene Lernplattform für Unternehmen
-
Individuelle Kurse
Häufig gestellte Fragen (FAQ)
In unserem zentralem Bereich Häufig gestellte Fragen (FAQ) finden Sie alle Antworten und die häufigsten Fragen zu Ihrem Thema.
Haben Sie Fragen?
Sie interessieren sich für eine Beratung oder eine Schulung und möchten sich dafür mit uns in Verbindung setzen?
Vereinbaren Sie gerne einen Termin für ein Gespräch : Kostenlos und unverbindlich.
Beratung: +49 34293 4797-20
Schulungen: +49 34293 4797-27

