UDI - Unique Device Identification für Medizinprodukte
Die Anforderungen rund um UDI sind komplex – viele Hersteller stehen vor der Herausforderung, alle Vorgaben der Medical Device Regulation (MDR) und In-vitro-Diagnostika-Verordnung (IVDR) korrekt umzusetzen.
UDI oder UDI Device Identifier (UDI-DI) oder UDI Production Identifier (UDI-PI) oder Basis UDI-DI?
Wir unterstützen Sie, den Überblick zu behalten.
Was ist die UDI und warum ist sie für Hersteller entscheidend?
Unique Device Identification
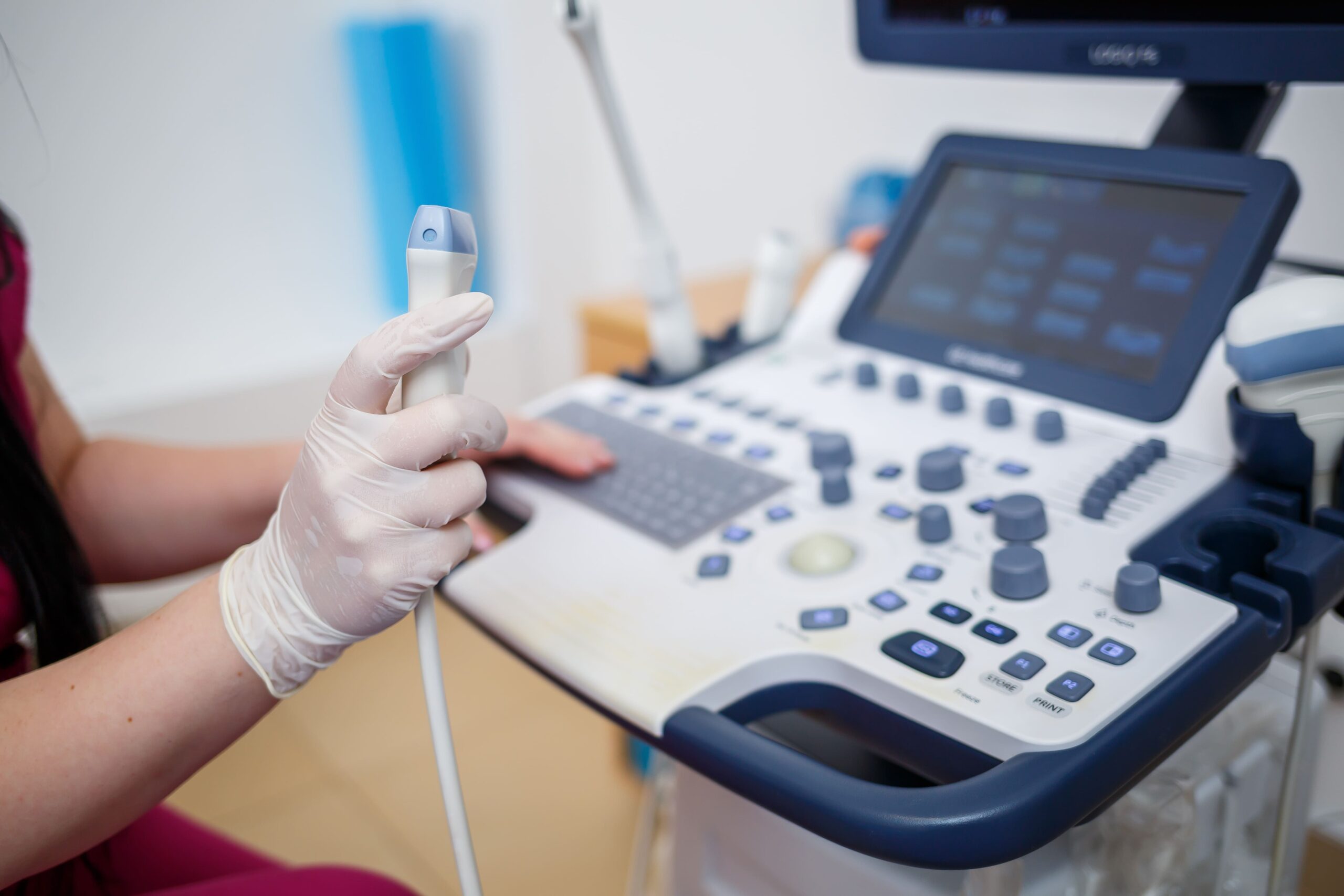
Die Unique Device Identification (UDI) ist ein weltweit standardisiertes System einmaliger Produktkennung für Medizinprodukte . Sie bildet einen zentralen Bestandteil der EU-Medizinprodukteverordnung (MDR 2017/745) und dient der Rückverfolgbarkeit, Patientensicherheit und Markttransparenz.
Hersteller sind verpflichtet, ihre Produkte mit einer UDI zu versehen und die entsprechenden Informationen in der europäischen Datenbank für Medizinprodukte EUDAMED zu hinterlegen. Diese Anforderungen gelten für nahezu alle Medizinprodukte – von einfachen Medizinprodukten bis hin zu komplexen Softwarelösungen. Außer: Sonderanfertigungen gemäß Artikel 2 Nr. 3 der MDR, Prüfprodukte (Produkte für klinische Prüfungen oder Leistungsstudien).
Damit der Lebenszyklus eines Medizinprodukts lückenlos nachvollziehbar ist, muss eine eindeutige Identifizierung des Produkts gewährleistet sein. Die Verordnung 2017/745 setzt dies durch die Einführung der Unique Device Identification (UDI) sowie die Einrichtung der zentralen Datenbank EUDAMED um. Jeder Hersteller von Medizinprodukten muss seine Produkte mit einem maschinell lesbaren Code (z. B. Barcode oder DataMatrix), einem menschenlesbaren Code kennzeichnen und die zugehörigen Daten in die UDI-Datenbank (UDID) eintragen – eine grundlegende Voraussetzung für die Zulassung innerhalb der EU.






























UDI-System
Allgemeine Informationen
1
Registrierungspflicht
Die Vergabe und Registrierung der UDI (Unique Device Identification) ist gesetzlich vorgeschrieben. Sie muss bei einer zugelassenen und akkreditierten UDI-Vergabestelle (Zuteilungsstellen) erfolgen – beispielsweise bei GS1.
2
Ziele und Schwerpunkte des UDI-Systems
Das UDI-System verfolgt mehrere zentrale Ziele:
a) Internationale Harmonisierung
Die weltweite Vereinheitlichung von Regelungen erleichtert den globalen Handel mit Medizinprodukten. Ziel ist die Angleichung von Gesetzen, Normen und technischen Standards.
Vorteile:
- Abbau von Handelshemmnissen
- Reduzierung von Handelsbarrieren
- Schaffung eines gemeinsamen Marktes
- Mehr Rechtssicherheit und Transparenz
- Stärkung des Patienten- und Verbraucherschutzes
- Kennzeichnung und Rückverfolgbarkeit
b) Verbesserung der Patientensicherheit durch Rückverfolgbarkeit von Medizinprodukten
UDI ermöglicht eine eindeutige Identifikation von Medizinprodukten und deren Herstellern/Wirtschaftsakteuren. Sicherheitsprobleme lassen sich dadurch schnell und präzise erkennen und beheben.
Nutzen:
- Klare Zuordnung von Produkten und Verantwortlichen
- Schnelle Reaktion bei Vorkommnissen
- Erhöhte Transparenz im Markt
c) Effizientere Rückrufaktionen
Dank der eindeutigen Kennzeichnung von Medizinprodukten und In-vitro-Diagnostika können betroffene Produkte schneller und gezielter aus dem Markt genommen werden.
d) Bekämpfung von Produktfälschungen
Gefälschte Medizinprodukte lassen sich durch UDI schneller identifizieren und entfernen. Die vollständige Erfassung in der EUDAMED-Datenbank erhöht die Sicherheit für Patienten und Anwender.
e) Optimierung von Prozessen in Gesundheitseinrichtungen
UDI-Daten unterstützen die Verbesserung interner Abläufe und stärken die Patientensicherheit durch präzise Dokumentation und Informationsweitergabe.
Beispielhafte Anwendungsbereiche:
- Rückverfolgbarkeit und Überwachung nach dem Inverkehrbringen von Produkten
- Optimierung von Beschaffung und Lagerhaltung
- Identifikation gefälschter Produkte
- Durchführung von Rückrufen
- Verbesserung interner und externer Meldeprozesse
- Entsorgung gemäß Herstellervorgaben
- Reaktion auf Rückmeldungen und Beschwerden
3
Wirtschaftsakteure (natürliche oder juristische Personen)
Wirtschaftsakteure sind natürliche oder juristische Personen, die im Rahmen der EU-Medizinprodukteverordnung (MDR) bestimmte Rollen im Produktlebenszyklus übernehmen.
Nr. | Wirtschaftsakteur | Bezeichnung | |
1 | Hersteller | MF | Manufacturer |
2 | Autorisierter Vertreter bzw. Bevollmächtigter | AR | Authorised Representative |
3 | Hersteller v. System- u. Behandlungseinheiten | PR | System & Procedure Pack Producer |
4 | Importeur | IM | Importer |
Hinweis: Ein Wirtschaftsakteur, der mehrere Rollen gleichzeitig ausübt, muss für jede Rolle separat registriert werden.
Unsere Leistungen rund um Unique Device Identification
Profitieren Sie von unserer langjährigen Erfahrung
Als erfahrene Berater im Bereich Regulatory Affairs und Qualitätsmanagement unterstützen wir Sie bei:
Ihre Vorteile durch unsere professionelle UDI-Beratung
Setzen Sie auf unsere Expertise
MDR Übergangsfristen für UDI-Kennzeichnung
Damit Sie auf dem aktuellen Stand sind
Die Kennzeichnung mit UDI-Trägern muss auf dem Produkt sowie auf allen darüberliegenden Verpackungsebenen erfolgen. Die Übergangsfristen gemäß MDR sind abhängig von der Risikoklasse des Produkts:
- Klasse III und implantierbare Produkte: 26. Mai 2021
- Klasse IIa und IIb Produkte: 26. Mai 2023
- Klasse I Produkte: 26. Mai 2025
Für wieder verwendbare Produkte, bei denen der UDI-Träger direkt am Produkt angebracht werden muss, gelten verlängerte Fristen:
- Klasse III und implantierbare Produkte: 26. Mai 2023
- Klasse IIa und IIb Produkte: 26. Mai 2025
- Klasse I Produkte: 26. Mai 2027
Hinweis: Die Einhaltung dieser Fristen ist entscheidend für die MDR-Konformität und die Marktverfügbarkeit Ihrer Produkte.
Höhere Effizienz. Kostensenkung.
Verbessertes Prozessmanagement
Profitieren Sie von unserer langjährigen Erfahrung in Regulierungsfragen und Qualitätsmanagementsystemen im Zusammenhang mit Medizinprodukten. Wir garantieren Ihnen Zeitersparnis und langfristige Vorteile dank unseres bewährten Systems zur elektronischen Verwaltung von Dokumenten.
Sprechen Sie uns an und fordern Sie noch heute ein unverbindliches Angebot an.
Häufig gestellte Frage zur UDI für Medizinprodukte
FAQ
Alle Medizinprodukte, die unter die EU-MDR oder IVDR fallen – inklusive Software.
Der Unique Device Identifier (UDI) ist ein weltweit eindeutiger, numerischer oder alphanumerischer Code, der zur Identifikation und Rückverfolgbarkeit von Medizinprodukten dient. Er ist verpflichtend gemäß EU-MDR und IVDR.
Basis UDI-DI = Die übergeordnete Kennung für eine Produktfamilie- Sie bleibt konstant bei Varianten
UDI-DI = Die spezifische Produktkennung – eindeutig für jede Verpackungseinheit
UDI-PI = Produktionsspezifische Informationen wie Chargennummer, Seriennummer, Herstellungs- oder Verfallsdatum.
Haben Sie Fragen?
Sie interessieren sich für eine Beratung oder eine Schulung und möchten sich dafür mit uns in Verbindung setzen?
Vereinbaren Sie gerne einen Termin für ein Gespräch : Kostenlos und unverbindlich.
Beratung: +49 34293 4797-20
Schulungen: +49 34293 4797-27

